最近,Roche的BTK抑制剂因肝损伤叫停了部分临床研究,其他一些经典药物,如PD-1抗体、CTLA-4抗体、对乙酰氨基酚等也存在肝毒性。通过这些经典药物,了解药物肝毒性的免疫学机制。
BTK抑制剂肝损伤
目前多款BTK抑制剂(例如默克的evobrutinib,赛诺菲的Tolebrutinib,罗氏的Fenebrutinib,强生ibrutinib等),均在临床及临床实验中报告肝毒性。
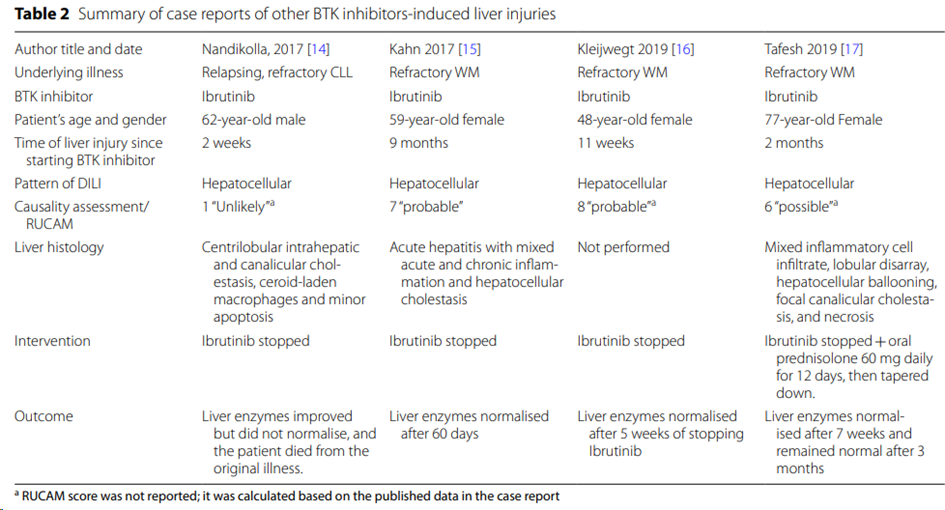
BMC Gastroenterol (2021)
BTK抑制剂诱导的肝毒性的发病机制尚不清楚。已经提出了几种机制,包括遗传变异引起的免疫机制、氧化损伤和线粒体功能障碍导致的直接肝毒性。
BTK抑制剂依赖细胞色素P450,但是会产生生物活化产物,被认为是酪氨酸激酶抑制剂诱导的肝毒性的起始事件。
免疫治疗肝毒性
肝毒性是PD-1抗体、CTLA-4抗体主要的irAEs之一,尤其是二者联用,发生率会激增(如下图)。
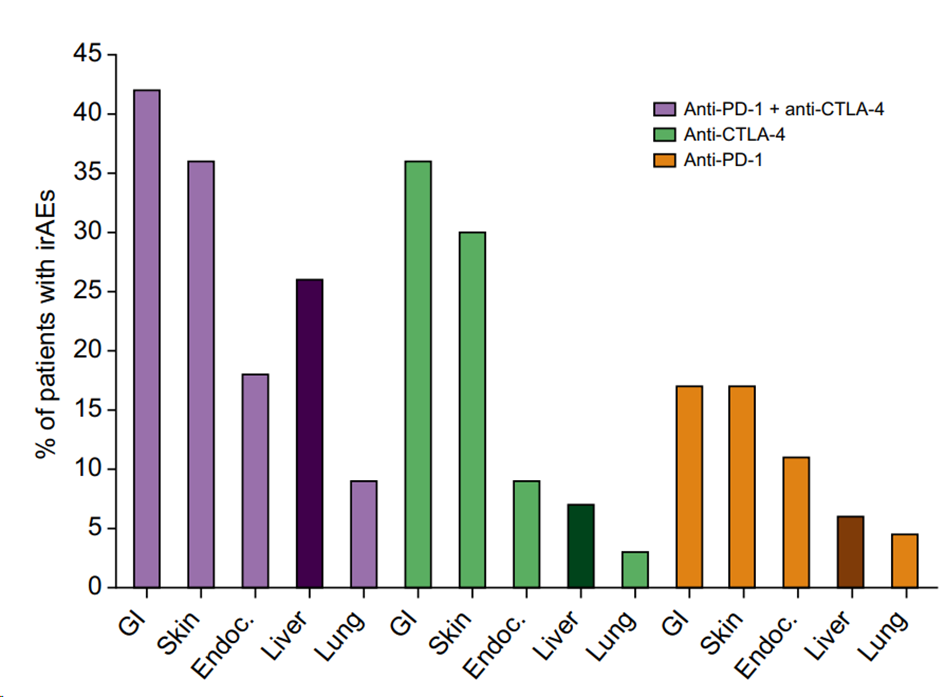
JHEP Rep. 2020
免疫检查点抑制剂的副作用,通常与不成比例和不受调节的免疫反应有关,如自身免疫性疾病。这反过来又会导致器官损伤,可能包括直接和间接的免疫相关细胞毒性作用。
PDL-1 是一种在多种组织和肿瘤中表达的跨膜蛋白。它的作用是保护细胞免受CD8+细胞毒性T淋巴细胞的攻击。PDL-1 与存在于T 细胞、B 细胞和髓系细胞中的 PD-1 结合并调节其抑制作用。因此,阻断 PDL-1/PD-1 通路会诱导细胞毒性活性并赋予对癌细胞的免疫反应,但也通过自身免疫反应造成组织损伤。此外,ICI 还可以改变CD8+ T 细胞的性质,使它们更容易合成细胞毒性物质,如干扰素 γ (IFN-γ)、颗粒酶和颗粒溶解素等。同样, CTLA-4 是一种位于调节性 T 细胞和活化 T 细胞表面的受体。在与抗原呈递细胞表面的CD80或CD86结合后,它通过抑制信号充当关闭开关,导致T细胞功能减弱,因此抑制这种受体允许T细胞高反应性。
活化和不受调节的T细胞引起的细胞毒性损伤被认为是免疫检查点抑制剂肝损伤的主要机制。
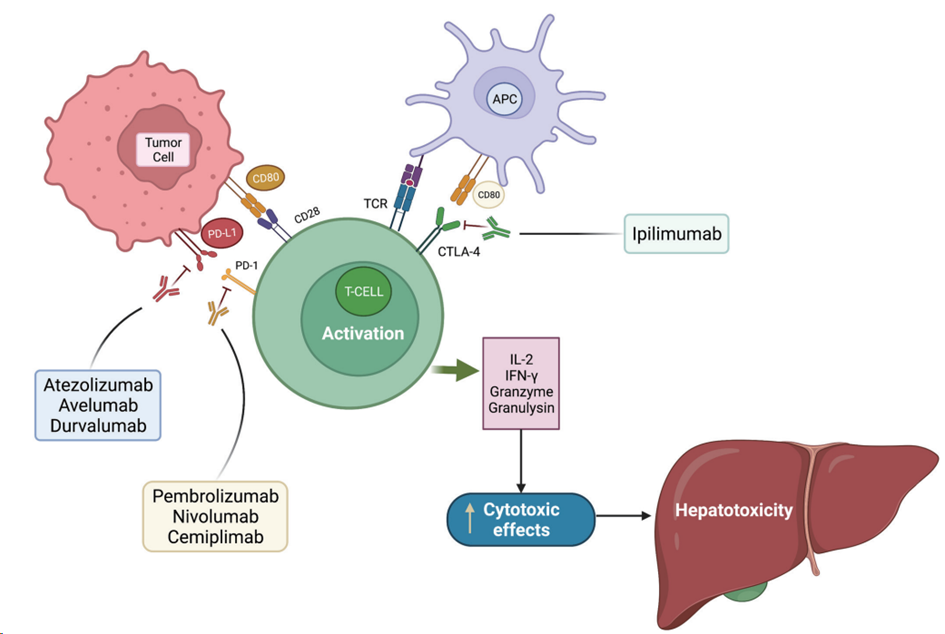
JHEP Rep. 2020
对乙酰氨基酚肝毒性
对乙酰氨基酚(Acetaminophen ,APAP) )是最常用的感冒药之一,因为超过剂量服用会造成肝毒性,甚至急性肝功能衰竭。
APAP 首先被细胞色素 P450 酶(主要通过 Cyp2E1)代谢,以产生毒性代谢物 NAPQI,其消耗肝脏 GSH 并与细胞和线粒体蛋白结合形成 APAP-加合物 (APAP-AD),导致线粒体氧化应激。
氧化应激和线粒体蛋白加合物的增加引发线粒体损伤。
受损的线粒体可导致细胞死亡、炎症和随后的肝损伤。
p62 是一种自噬受体蛋白,被募集到 APAP-AD,促进 APAP-AD 转变为不溶性形式,被自噬体识别和隔离,并最终被自噬溶酶体去除。
受损的线粒体可以通过 PINK1-Parkin 介导的选择性线粒体自噬去除。
受损的线粒体可以稳定线粒体PINK1,该线粒体 PINK1 将 Parkin 募集到线粒体以触发线粒体蛋白的泛素化。线粒体泛素化-p62-LC3 复合物,通过线粒体自噬促进受损线粒体的识别和去除。除了 PINK1/Parkin 通路外,其他几种线粒体外膜蛋白(FUNDC1、Bnip3 和 Nix)可能通过其 LC3 相互作用区域直接与 LC3 相互作用,介导不依赖 PINK1- Parkin 的线粒体自噬。
自噬可以通过去除受损的线粒体和线粒体DNA 来抑制炎症和炎症小体活化。Torin 1 或雷帕霉素可以靶向 ULK1 复合物以诱导自噬,通过去除 APAP 加合物和受损的线粒体来防止 APAP 诱导的肝损伤。
相反,3-MA 抑制 VPS34 复合物以抑制上游自噬体的形成,而亮抑酶肽或 CQ 损害自体溶酶体/溶酶体功能,分别导致 APAP 诱导的坏死和肝损伤加重。
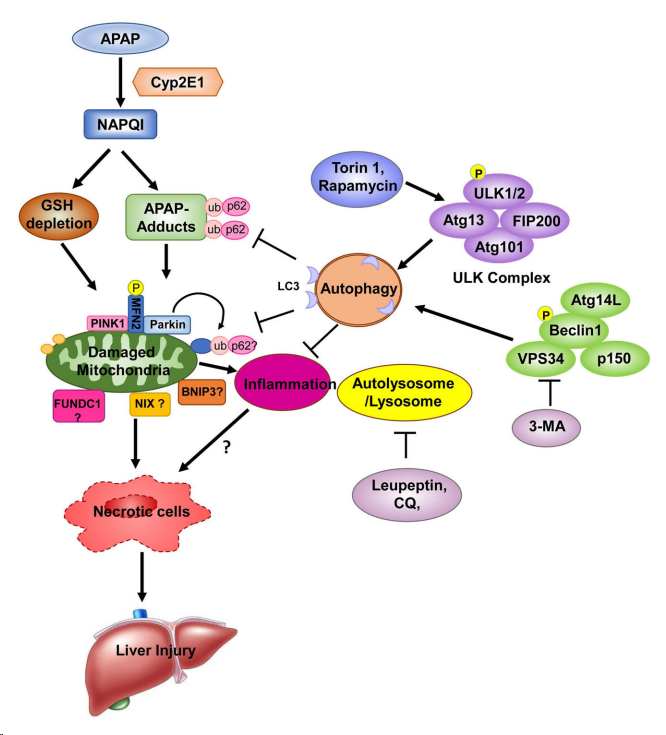
Liver Int. 2018
参考资料
Roche/GenentechFenebrutinib: https://www.gene.com/media/statements/ps_113023
Atallah et al.Zanubrutinib-induced liver injury: a case report and literature review,BMC Gastroenterol (2021) 21:244 https://doi.org/10.1186/s12876-021-01825-2
Eleonora De Martin et al, Liver toxicity as a limiting factor to the increasing use of immune checkpoint inhibitors,JHEP Rep. 2020 Aug 11;2(6):100170. doi: 10.1016/j.jhepr.2020.100170.
Da Cunha T. et al.Immunotherapy-induced Hepatotoxicity: A Review,Journal of Clinical and Translational Hepatology 2022,DOI: 10.14218/JCTH.2022.00105
Chao et al.Role and Mechanisms of Autophagy in Acetaminophen-induced Liver Injury,Liver Int. 2018 August ; 38(8): 1363–1374. doi:10.1111/liv.13866.














